Allereerst dien ik te vermelden dat ik geen stralingsdeskundige ben, en deze informatie bij elkaar heb gesprokkeld via internet, met wat feed-back hier en daar. Ook heb ik van deskundigen in het veld feedback gekregen. Dit alles in een poging om de medische behandeling met RAI die ik heb ondergaan in een logische samenhang te begrijpen, én te kunnen presenteren aan andere leken. De inhoud van dit artikel zal daarom de komende tijd wellicht nog gecorrigeerd of aangevuld kunnen worden met nieuwe informatie.
Radium
Zoals je misschien uit -RAI-1 Mijn Verhaal- hebt kunnen opmaken, ben ik niet zo’n voorstander van een medische behandeling met radio actieve straling. Maar er is wel een ander soort radium-straling waar ik helemaal idolaat van ben, en dat is de zon!
I LLLLOOOOOOVVVVVVEEEEEEE IT!
Oké en dan nu een beetje technisch…
Radio-actief jodium
Dit artikel gaat over het isotoop Radio-actief jodium. En voor degenen die dat nog niet weten, isotopen zijn de benoemingen van chemische elementen uit het periodiek systeem.
Dat is ook terug te vinden in de betekenis van het woord. ‘Isotoop’, stamt uit het Grieks: ‘isos’ = ‘dezelfde’ en ’topos’ = ‘plaats’. Hiermee wordt aangegeven dat verschillende isotopen van één en hetzelfde element, in dit geval de stof jodium, dezelfde plaats innemen in het periodiek systeem.
Jodium Isotopen
Van de stof jodium is er maar één isotoop dat in een natuurlijke samenstelling op Aarde aanwezig is. Deze wordt omschreven als ‘I-127’. Dat staat voor Iodine-127. (Iodine is het Engelse woord voor Jodium). Daarnaast zijn er 26 radio-actieve isotopen van jodium door mensen geproduceerd. Deze worden ‘radio-isotopen’ genoemd, waartoe ondermeer de I-123 en I-131 behoren. Dit zijn twee gangbare vormen van radio-actief jodium welke voor medische doeleinden worden gebruikt, en derhalve ook worden beschreven als medische isotopen.
Misschien ook nog interessant om te vermelden, is dat het langst levende door mensen vervaardigde isotoop van het element jodium, I-129 is, volgens wikipedia met een halveringstijd van 15,7 miljoen jaar (maar of we dat voor zo’n lange tijd zeker kunnen weten?), waarna het vervalt door β-verval naar de stabiele isotoop xenon-129.
Iodine
Zoals eerder geschreven in deel 1 van deze artikelen reeks, de ‘I’ van de afkorting voor de jodium isotopen staat voor ‘Iodine’, het Engelse woord voor Jodium. Doorgaans wordt de Engelse ‘I’ ook als afkorting internationaal gebruikt in de wetenschap voor de omschrijving van het element Radio Actief Jodium dus RAI, en hanteren we dat ook voor dit artikel. In het Nederlands wordt RAJ echter ook wel met de J van Jodium aangeduid.
Jodium en de schildklier
Het Engelse woord ‘Iodine’ is afkomstig van het Griekse ‘iodius’ wat ‘violet’ betekent en verwijst naar de kleur van jodium als dit verdampt. Jodium is een van nature voorkomende stof en voor de stofwisseling onmisbaar. Jodium concentreert zich in de schildklier aangezien dit orgaan als een soort mini-fabriekje schildklierhormoon produceert met behulp van jodium. Dat doet de schildklier door jodium en eiwitten uit onze voeding afkomstig, wat is verteerd en opgenomen in het bloed, in de schildklier aan elkaar te koppelen.
T3 en T4
Door dit proces worden verschillende moleculaire-samenstellingen van schildklier-hormoon geproduceerd, die alle een specifieke werking in het lichaam en cel-metabolisme hebben. De twee voornaamste daarvan worden omschreven als ‘T3’ en ‘T4’. Er zijn echter méér varianten (T1, T2 enz), en óók nog eens in vrije vorm, bijvoorbeeld VrijT3.
De T verwijst naar het aminozuur ‘Tyrosine’, wat als eiwitonderdeel de bouwsteen vormt voor de twee soorten schildklierhormoon ‘Thyroxine’ (T4), en ‘Tri-iodo-thyronine’ (T3). Dus die T staat voor het eiwit onderdeel van het schildklierhormoon moet je maar denken. Het woord ‘Thyreoiedes’ begint overigens ook met een T, het stamt uit het Grieks en betekent schild, n.a.v. de vorm van de schildklier.
Het getal 3 of 4 achter de T verwijst naar het aantal jodium atomen wat aan het eiwit-aminozuur Tyrosine gekoppeld is. De verschillende getalcombinaties, om het zo maar even te zeggen, hebben ook een verschillende werking die alle benodigd zijn voor een goede stofwisseling. Maar dat is weer een boek apart, of beter gezegd, er zijn gigantisch veel boeken over de werking van de schildklier geschreven. Hele goeie op het gebied van T3 zijn die van Paul Robinson, zoals het eerste boek wat hij schreef: ‘Recovering with T3’.
Calcium huishouding
De schildklier maakt overigens ook nog een andere stof aan, te weten Calcitonine (helpt opname van calcium in de cellen en remt de afbraak van botweefsel). Er zijn rondom de schildklier ook nog miniscule bij-schildkliertjes. Deze zijn zo klein als een rijstkorrel, maar produceren het belangrijke Parathormoon. Dit hormoon helpt bij de opname van calcium in de botten. Beide stoffen zijn dus verantwoordelijk voor de calcium huishouding. Schildklierhormoon wordt door alle cellen in het lichaam opgenomen, en concentreert zich in ondermeer de maag, klieren met inwendige secretie, en andere organen en weefsels.
Stabiel atoom
Nu dan even richting het radio-actieve gedeelte. Een atoom is de kleinste bouwsteen van materie, en dus ook van onze weefsels.
Normaal gesproken vormen in een atoom de Protonen en Neutronen samen de positief geladen (+) atoomkern. De negatief geladen (-) Elektronen zweven daar omheen in een stabiele toestand. Wanneer + en – in balans zijn is een atoom neutraal. Dat wil zeggen dat de celkern en de omhulling elkaar in evenwicht houden.
Radio-isotoop
Dat is dus niet het geval bij de radio-isotopen van radio actief jodium, welke van nature niet op Aarde voorkomen. Deze zijn door mensen vervaardigd en onstabiel gemaakt waardoor de Protonen en Neutronen in de celkern en de Elektronen er om heen in de schil van de atomen, niet meer in evenwicht zijn met elkaar. Daardoor zijn de isotopen radio-actief geworden. En die zijn dan ook van een geheel andere orde.
Radio actieve stoffen zoals Jodium I-131 en I-123 worden echter als de zogenaamde ‘medische isotopen’ ingezet. Er worden ook medische radio-isotopen van andere stoffen gemaakt (zoals kobalt, erbium, iridium, goud, fosfor, strontium, enzovoort), maar die worden in dit artikel niet besproken aangezien wij ons toespitsen op RAI).
Atoom-massa
Waar staan de getallen 123 en 131 achter de ‘I-‘ voor? De getallen geven de atoommassa aan van het chemische element. Zoals eerder geschreven: elk atoom bevat een celkern met daarin protonen en neutronen. Om de massa van de celkern heen zweven in een wolk de elektronen. Het aantal protonen in de celkern bepaalt de chemische eigenschappen van het atoom, wat is onder gebracht in atoomnummers. Het chemische element jodium bevat 53 protonen in de celkern, wat daarmee dus tevens het atoomnummer van jodium is.
Het aantal neutronen in de celkern van verschillende jodium stoffen kunnen echter van elkaar verschillen. I-131 bevat naast de 53 protonen, 78 neutronen in de celkern. De protonen en neutronen bij elkaar opgeteld vormen de atoommassa (53 + 78 = 131). Dus 131 is de totale massa van de celkern. In het geval van I-123 is de atoommassa 123 (53 + 70 = 123). Volg je het nog? Ja het duurde bij mij ook even…
Jodium radio-isotopen
Verschillende radio-actieve jodium isotopen zoals Jodium I-131 en I-123 ontstaan door kernsplijting van zwaardere elementen in de kernreactoren, zoals de splijtingsstoffen Uranium en Telluur. Bij beide stoffen gebeurt dat door de celkernen middels neutronenbestraling te verzwaren, waardoor de cellen uit balans raken en gaan stralen.
Als ik het goed heb begrepen kunnen van ander splijtingsmateriaal de celkernen ook met protonen bestraald worden (waardoor de chemische samenstelling veranderd). En bij weer andere stoffen worden juist middels straling de elektronen rondom de kern weggeslagen dus verwijderd, waardoor een atoom ook onstabiel wordt, zowel bij de volledige verwijdering van de elektronen als een gedeelte ervan.
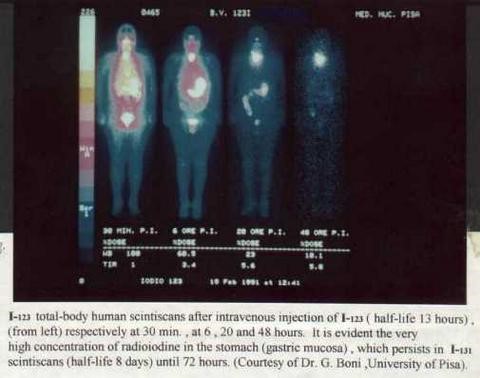
I-123
Jodium I-123 of 123I is een onstabiele isotoop. Het heeft een halfwaardetijd van 13 uur. Het is een halogeen (gasvorm) en hoopt zich in het lichaam op in de schildklier en andere jodium verwerkende weefsels. Het wordt voor medische doeleinden gebruikt in de nucleaire geneeskunde. Middels deze radio-actieve stof worden bijvoorbeeld kankercellen in het lichaam opgespoord of wordt het gebruikt als lage dosering voor een schildklier-uptake scan (waarbij de productie capaciteit en de omvang van het orgaantje wordt gemeten). I-123 wordt intraveneus toegediend en vervolgens getraceerd met behulp van een speciale gamma camera.
Op Wikipedia org wordt omschreven dat I-123 ontstaat uit xenon-124 door het te bestralen met protonen. Hierdoor gaat het wegens afgifte van een neutron en een proton over in xenon-123, of het gaat over onder afgifte van twee neutronen in cesium-123 ook omschreven als 123Cs. Dit cesium-123 vervalt zelf ook tot xenon-123. Deze isotoop bezit een halfwaarde tijd van 2 uur en vervalt verder tot jodium I-123.
I-131
Jodium I-131 of 131I, heeft een halfwaardetijd van 8 dagen. Het wordt als natrium-jodide zowel voor diagnose als behandelmethode gebruikt. Het is een onstabiel radio-isotoop en is een afvalproduct van kernsplijting van uranium (U-235- 3%), wat tot stand komt middels bestraling met neutronen van de celkernen. I-131 komt ook vrij bij de splijting van hoogverrijkt Uranium (HEU-> 20%). U-235 bevat volgens wetenschappers een halfwaardetijd van 703,8 miljoen jaar (maar of deze tijdsaanduiding ook echt juist is zullen we dus pas tezijnertijd te weten komen).
Het nuclide zendt zowel bèta- als gammastraling uit, maar straalt grotendeels met bèta straling voor zo’n 90%. De bèta’s vernietigen o.a. verschillende soorten (schildklier) tumorcellen, en worden ook ingezet bij een te snel werkende- of vergrote schildklier.
De gammastraling is de stralingsvorm wat het jodiumhoudend weefsel zichtbaar maakt onder een gamma-camera. De radio-actieve vorm Jodium I-131 kan echter als deeltjes-bètastraler mutaties veroorzaken in het DNA (dus ook van gezonde cellen), en in grotere hoeveelheden leiden tot de dood.
Voor de productie van I-131 wordt volgens stichting Laka.org echter doorgaans het metalloïde Telluur-130 (Te-131 of 131Te) gebruikt, waarvan de celkernen eveneens bestraald (of ‘gebombardeerd’) worden met neutronen. Telluur is een bros metaalachtig mineraal en een vrij zeldzaam element dat meestal in gebonden toestand in de natuur voorkomt (zoals het mineraal Calaveriet).
Het aantal neutronen bepaalt echter onder meer de stabiliteit van de kern. Door het toevoegen van extra neutronen middels straling, neemt de + energie toe in de celkern. Deze is nu in plaats van neutraal, verworden tot een met surplus positief geladen atoom of molecuul. Er is nu immers méér + dan – energie.
Ionisatie
Bèta straling wordt ook wel ioniserende straling genoemd. Wanneer een atoom uit balans is geraakt, gaat het een evenwicht zoeken omdat het alleen kan functioneren in neutraliteit. Dat doet het door extra elektronen buiten zichzelf te zoeken, het wordt er als het ware naar toe getrokken (de tegenpolen + en – trekken elkaar aan). Het wil weer in evenwicht raken met de verzwaarde atoommassa in de celkern.
Hierdoor raakt het in beweging, maar heel sterk één richting uit, waardoor het simplistisch uitgelegd z’n evenwicht kwijt raakt. Het valt als het ware om en blijft met hoge snelheid rondspinnen in de zucht naar elektronen. Dit veroorzaakt wrijving, en daarmee dus hitte of straling.
Nu is de instabiele atoomkern veranderd in wat een ‘ion’ wordt genoemd. Dit is een uit balans geraakte atoomkern, die pulserend elektromagnetische straling afgeeft met een hoge frequentie. Dit wordt dus ‘ionisatie’ genoemd. De stof is daarmee ook halogeen geworden, het verkeert in een luchtige toestand door de snelle beweging, als een gas, omdat het in verhouding minder elektronen heeft dan het surplus aan neutronen in de celkern.
De ionisatie veroorzaakt ook wrijving in de omringende atmosfeer van het atoom of molecuul. Deze wrijving is voldoende om door het ontstane elektromagnetische vacuüm, elektronen van naburige atomen aan te trekken. Als de straling sterk genoeg is, zal deze zelfs de elektronen van de naburige atomen verwijderen door de sterke electromagnetische aantrekkingskracht. Dit is dus Bètastraling, een ioniserende straling van beta deeltjes die elektronen of positronen afgeven.
Deze ioniserende atomen zijn doorgaans zeer reactief en reageren met elk atoom of molecuul dat toevallig in de buurt is. Bij nóg sterkere straling wordt zelfs de kern van naburige cellen gesplitst. Dat is een ioniserende radio-actieve kettingreactie en spreken we van kernsplijting.
Afhankelijk van de stralingssterkte en de werking van ionisatie tijdens het verval, kan ionisatie cellen vernietigen (volledig opbranden), beschadigen (de celwerking is verminderd), maar ook leiden tot mutatie (de cel is beschadigd maar kan toch nog functioneren, zij het in gehavende vorm, en zich als zodanig ook nog delen of vernieuwen, maar is dan energetisch verzwakt, waardoor ongezonde celgroei kan ontstaan).
Verval
De halfwaardetijd of halveringstijd, wat het radio-actief verval is, hangt af van de sterkte van de straling. Het medisch isotoop I-131 heeft een halfwaardetijd van 8 dagen. Dat betekent dat na elke 8 dagen, de straling voor de helft afneemt. Daarna straalt het voor precies de helft van de stralingssterkte weer 8 dagen, en daarna voor een kwart van de stralingssterkte, enzovoort, tótdat de straling stabiel is geworden en uitdooft. Tijdens dat proces vervalt I-131 naar een andere atoomsoort, het isotoop xenon Xe-131, en is daarmee weer stabiel geraakt. Dit is vanzelfsprekend ook een halogeen, met miniscule kleine reststofdeeltjes. Hoe dit gas zich in het lichaam gedraagt, en of dit gas het lichaam verlaat is mij niet bekend.
I-131 en I-123 zijn dus halogene ioniserende stoffen die zijn vrijgekomen bij kernsplijting van Uranium of Telluur en zijn daarmee in feite een afvalproduct. Deze stoffen komen ook vrij bij kernrampen (zoals in 1986 nabij de stad Tsjernobyl in de Oekraïne & Rusland, en in 2011 in de provincie Fukushima te Japan). Daarbij komen eveneens cesium Ce-134 (halfwaardetijd 2 jaar) en cesium Ce-137 (halfwaardewijd 30 jaar) en Strontium-90 vrij (halfwaardewijd 29 jaar). Het I-131 ontstaat hierbij ondermeer ook na het radio-actief verval van telluur-131 (Te-131 of 131Te).
C-137 en Sr-90
Na de kernramp in Fukushima is een hoog percentage beschadigde schildklieren onder de bevolking gemeten. Bij de lichamelijke ontwikkeling van kinderen en jongeren kan het zowel de fysieke als de mentale groei belemmeren. Bij volwassenen veroorzaakt straling een zeer breed scala van bijkomende aandoeningen, waaronder kanker.
Cesium-137 verspreidt zich door het hele lichaam, maar heeft de neiging zich op te hopen in de spieren, het heeft een affiniteit met kalium. Strontium-90 bootst calcium na, wedijvert ook met magnesium (het zijn elkaars antagonisten) en hoopt zich meer op in onze botten en ook de ruggegraat.
Meet-eenheden
Er is een internationaal systeem van SI-eenheden en voorvoegsels (SI Units en Prefixes), welke officiële status heeft gekregen, en is aanbevolen voor universeel gebruik door de Algemene Conferentie over Gewichten en Maatregelen.
Hierin zijn opgenomen diverse meeteenheden voor diverse vormen van straling, zoals curie, rad, rem, roentgen, gray, sievert, coulomb. Bovendien komen deze in verschillende doseringen zoals tera (T), giga (G), mega (M), kilo (k), centi (c), milli (m), micro (µ) en nano (n).
mCi en Mbq
Ik beperk mij tot de eenheden waar ik met mijn medische behandeling mee te maken heb gehad. Dat zijn Millicuries (mCi) en Megabecquerels (Mbq). Millicuries (mCi) worden in het SI Unit systeem beschouwd als een algemene unit en zijn de Engelse meeteenheid voor radio-activiteit. De Becquerels (Bq) zijn de meeteenheid die in Europa wordt gehanteerd.
Van de Millicuries is één Curie de hoeveelheid van een radioactieve stof die met een snelheid van 3,7 x 1010 desintegraties per seconde vervalt.
The International System of Units for Radiation Measurements geeft weer:
Common Units: Radio-activity: curie (Ci), Absorbed Dose: rad, Dose Equivalent: rem, Exposure: roentgen (R).
SI Units: Becquerel (Bq), Absorbed Dose: gray (Gy), Dose Equivalent: sievert, Exposure: coulomb/kilogram (C/kg).
Volledigheidshalve plaats ik hier ook de technische definite zoals ik dit op internet gevonden heb, veel info op de website van
The International League Of Atomic Women:
Een millicurie (mCi) Is een decimale fractie van de gedeprecieerde niet-SI-eenheid van radioactiviteit gedefinieerd als 1 Ci (is 1 curie) = 3,7 × 10¹⁰ verval per seconde. Eén curie is ruwweg de activiteit van 1 gram van de radium-isotoop ²²⁶Ra.
Een megabecquerel (Mbq) Een becquerel (Bq) is het aantal atoomkernen dat per seconde radio-actief vervalt. 1 Bq = 0.0000010 MBq. Bq is de SI afgeleide eenheid van stralingsactiviteit. De Bq wordt gedefinieerd als de activiteit van een hoeveelheid radioactief materiaal waarin één kern vervalt per seconde. De becquerel is daarom equivalent aan een inverse seconde, s⁻¹.
Mijn dosering I-131
Voor de definitieve behandeling van mijn te snel werkende schildklier heb ik toendertijd in Amerika 18 Millicuries I-131 toegediend gekregen. Dat is omgerekend voor de Europese meeteenheid in Mega-becquerels: 666 MBq. Dat wist ik ten tijde van de inname niet. Ik wist helemaal niks van straling af. De internist in Amerika had mij verteld dat de dosering was voorgesteld door mijn endocrinoloog in Nederand. Voorheen had ik al twee keer een schildklier-uptake scan gehad in Nederland, wat wordt uitgevoerd met het I-123, wat een halfwaardetijd van 13 uur heeft. In totaal heb ik dus méér straling binnen gekregen dan de genoemde 18 mCi dosering.
De Millicuries zijn overigens vernoemd naar de dubbelvoudige nobel prijs winnaar Marie Curie (1867-1934) die tevens de benoemer van ‘radioactiviteit’ is. Zij werkte samen met haar echtgenoot en mede nobelprijs winnaar uitvinder Pierre Curie. Om het gedrag van Uranium en Thorium te beschrijven baseerde zij radio-activiteit op het Latijnse woord voor zonnestraal ‘radium’ of ‘radii’.
De Becquerel is vernoemd naar Antoine Henri Becquerel.
Norm radium-emissies
Marie Curie behaalde ook het recht om een internationale norm voor radium emissies te definiëren. Een dergelijke norm was essentieel voor een efficiënte radium industrie en uniforme medische toepassingen. De maatregel die zij instelde, werd aanvaard door de internationale wetenschappelijke gemeenschap, die het de ‘Curie’ noemde.
Zij en haar echtgenoot moesten echter op latere leeftijd hun door velen bejubelde ‘magische’ uitvinding met de dood bekopen, omdat zij en vele anderen, onkundig van de bijwerkingen van radio-actieve straling, hier onzorgvuldig mee waren omgegaan. In een brief schreef zij vlak voor haar sterven aan haar nicht in 1886:
“My plans for the future? I have none….I mean to get through as well as I can, and when I can do no more, say farewell to this base world. The loss will be small, and regret for me will be short….”
Het heeft voor mij als auteur van dit artikel en ervaringsdeskundige een soort nostalgische waarde dit te lezen, en het sentiment is mij niet geheel oneigen. Evengoed probeer ik uit elke dag het beste te halen, en van alle mooie momenten die het leven biedt te genieten. Ook al is de letselschade door straling voor mij met enige regelmaat zwaar te dragen (elke dag wel), er is nog steeds véél waard om voor te leven.
In deel 3 ga ik verder in op de gevolgen van radio-actieve staling middels kernenergie voor de natuur en onze maatschappij.
DEEL EEN RAI MIJN VERHAAL
DEEL TWEE RAI WAT IS HET?
LEES VERDER:
DEEL DRIE RAI EN KERNENERGIE
En dan ter afsluiting van deel twee nog even het motto van de website van
The International League Of Atomic Women:
“We may as well move forward, because we can’t go back”.
© 2024 | Margreet Wilschut – Atomic Woman
Bron: www.margreetotto.net


